- Elektrochemie a galvanické pokovování
- Proces elektrolýzy nebo nabíjení baterií
- Galvanické pokovování
- V elektronice
- Závěr
Pomozte vývoji webu a sdílení článku s přáteli!
Mezi pojmy v elektrotechnice existují takové pojmy jako anoda a katoda. To platí pro zdroje energie, galvanické pokovování, chemii a fyziku. Termín je také nalezený ve vakuu a polovodičové elektronice. Označují zjištění nebo kontakty zařízení a jaké elektrické označení mají. V tomto článku vám řekneme, co jsou anody a katody, a jak určit, kde se nacházejí v elektrolyzéru, dioda a baterie, z nichž je plus a mínus.Elektrochemie a galvanické pokovování
Elektrochemie má dvě hlavní sekce:
- Galvanické články - výroba elektřiny v důsledku chemické reakce. Mezi tyto prvky patří baterie a akumulátory. Často se nazývají chemické zdroje proudu.
- Elektrolýza - vliv na chemickou reakci elektřiny, jednoduchými slovy - pomocí zdroje energie, je spuštěna nějaká reakce.
Zvažte redoxní reakci v galvanické buňce, pak jaké procesy probíhají na jeho elektrodách?
- Anoda - elektroda, na které je oxidační reakce, to znamená, že se vzdává elektronů. Elektroda, na které probíhá oxidační reakce, se nazývá redukční činidlo.
- Katoda je elektroda, na které probíhá redukční reakce, to znamená, že přijímá elektrony. Elektroda, na které dochází k redukční reakci, se nazývá oxidační činidlo.
To vyvolává otázku - kde je plus a kde je minus baterie? Na základě této definice anoda dodává elektronům galvanický článek.
Je to důležité! V GOST 15596-82, oficiální definice jmen závěrů chemických zdrojů proudu je dána, jestliže krátce, pak plus u katody, a mínus u anody.
V tomto případě je uvažován průtok elektrického proudu skrze vodič vnějšího obvodu z oxidačního činidla (katoda) do redukčního činidla (anoda). Protože elektrony v obvodu proudí z mínus na plus a elektrický proud je opačný, pak katoda je plus a anoda je mínus.
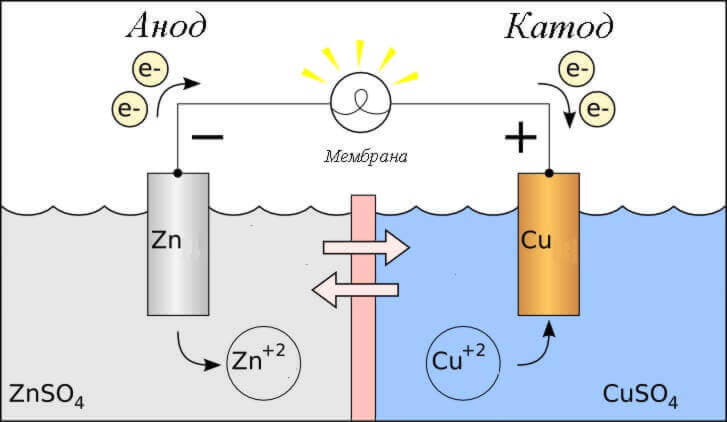
Varování: proud proudí vždy do anody!
Nebo stejné na diagramu:

Proces elektrolýzy nebo nabíjení baterií
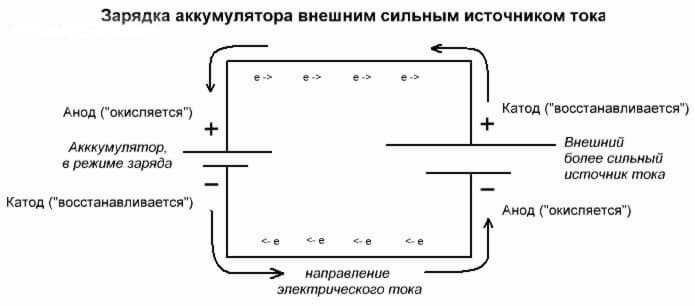
Tyto procesy jsou podobné a inverzní k galvanickému článku, protože to není energie, která pochází z chemické reakce, ale naopak - chemická reakce nastává v důsledku vnějšího zdroje elektřiny.
V tomto případě, plus napájecí zdroj, je všechno také nazýváno katodou a mínus anoda. Ale kontakty nabíjecího galvanického článku nebo elektrody elektrolyzéru již budou mít opačné názvy, podívejme se proč!
Je to důležité! Když je galvanická buňka vybitá, anoda je mínus, katoda je plus, při nabíjení je to naopak.
Vzhledem k tomu, že proud z kladného výkonu napájecího zdroje jde na kladný výstup baterie, nemůže být již katoda. S odkazem na výše uvedené lze konstatovat, že v tomto případě elektrody baterie při nabíjení podmíněně mění místa.
Potom se elektrodou dobíjecího galvanického článku, do kterého proudí elektrický proud, nazývá anoda. Ukazuje se, že při nabíjení na baterii se plus stává anoda a mínus katoda.
Galvanické pokovování
Procesy ukládání kovů v důsledku chemické reakce pod vlivem elektrického proudu (při elektrolýze) se nazývají galvanické pokovování. Svět tak obdržel postříbřené, pozlacené, pochromované nebo jiné kovem potažené šperky a díly. Tento proces se používá jak pro dekorativní, tak pro aplikované účely - ke zlepšení korozní odolnosti různých součástí a sestav mechanismů.
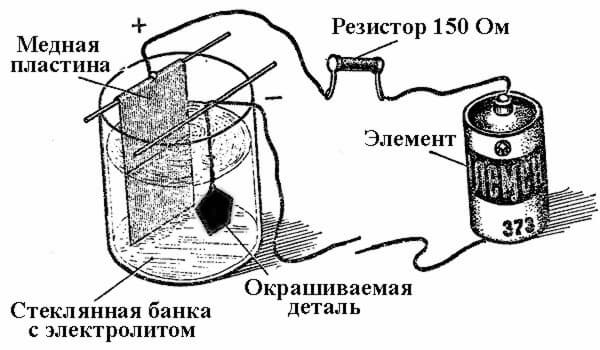
Princip činnosti zařízení pro galvanické nanášení spočívá v použití roztoků solí prvků, se kterými bude díl potažen jako elektrolyt.
Při elektrolytickém pokovování je anoda také elektrodou, ke které je připojen kladný výstup zdroje energie, v tomto případě je katoda mínus. V tomto případě je kov uložen (redukován) na zápornou elektrodu (redukční reakce). To znamená, že pokud chcete udělat pozlacený kroužek vlastníma rukama, připojte k němu záporný vodič napájecího zdroje a vložte jej do nádoby s vhodným roztokem.
V elektronice
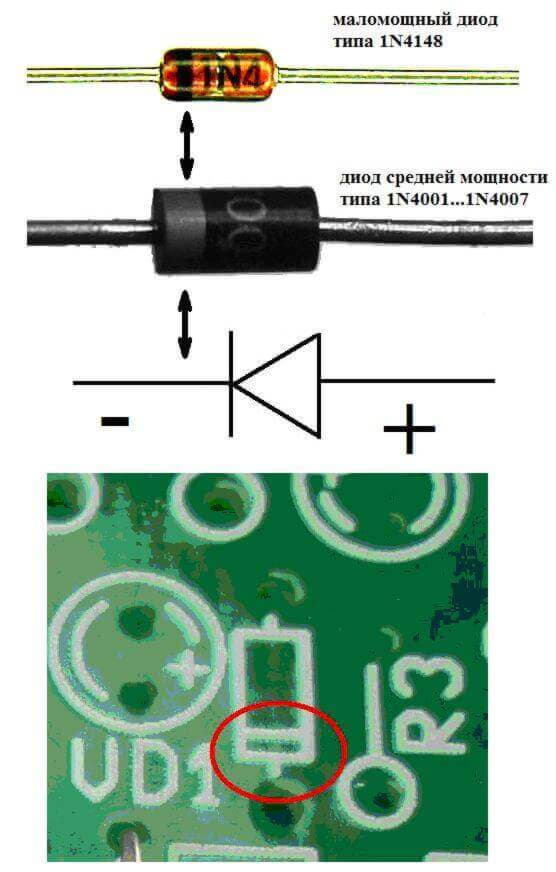
Elektrody nebo nohy polovodičových a vakuových elektronických zařízení jsou také často nazývány anodou a katodou. Zvažte podmíněné grafické označení polovodičové diody v diagramu:

Jak je vidět, anoda diody je připojena k pozitivní baterii. To je nazýváno ze stejného důvodu - v tomto případě proud v každém případě proudí do výstupu diody. Skutečný prvek na katodě má proužkové nebo tečkové značení.
LED je podobná. Na 5 mm diodách LED jsou skrz banku viditelné vnitřnosti. Polovina, která je větší, je katoda.
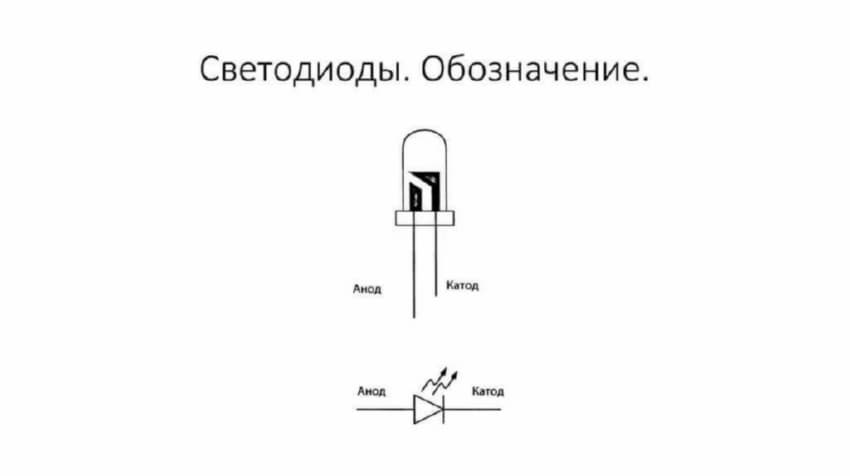
Situace s tyristorem je také stejná, přiřazení pinů a „unipolární“ aplikace těchto tříkomponentních komponent z něj činí řiditelnou diodu:
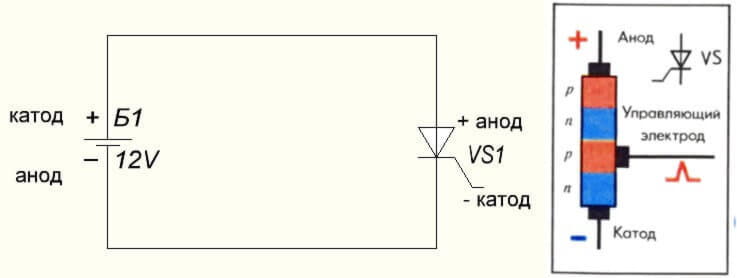
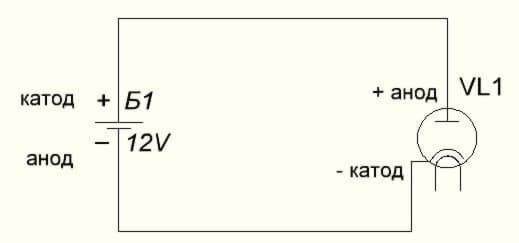
Ve vakuové diodě se anoda připojuje také k kladné a katoda k záporné hodnotě, která je znázorněna na následujícím diagramu. I když použití reverzního napětí - názvy těchto prvků se nezmění, a to i přes tok elektrického proudu v opačném směru, i když nevýznamné.
U pasivních prvků, jako jsou kondenzátory a odpory, je situace jiná. Rezistor neodděluje katodu a anodu, proud v ní může proudit v libovolném směru. Jeho závěry můžete v závislosti na situaci a zvažovaném režimu uvést. V běžných nepolárních kondenzátorech. Méně často se toto oddělení podle jména kontaktu pozoruje v elektrolytických kondenzátorech.

Závěr
Abychom to shrnuli, odpověděli na otázku: jak si vzpomenout, kde je plus, kde je mínus na katodě s anodou? Pro elektrolýzu, nabíjení baterií, galvanické pokovování a polovodičová zařízení existuje vhodné mnemonické pravidlo. Tato slova s podobnými názvy mají stejný počet písmen, který je znázorněn níže:
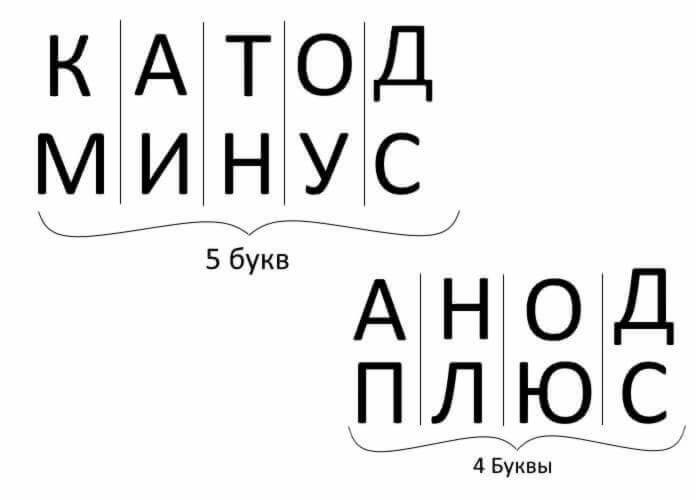
Ve všech těchto případech proudí proud z katody a proudí do anody.
Nenechte se zmást zmatkem: „Proč má baterie katodu pozitivní a když je nabitá, stává se zápornou?“. Nezapomeňte se všemi prvky elektroniky, stejně jako s elektrolyzéry a při galvanickém pokovování - obecně, pro všechny spotřebitele energie, výstup připojený k plusu se nazývá anoda. To je místo, kde rozdíly končí, nyní je pro vás jednodušší zjistit, co je plus, co je negativní mezi výstupy prvků a zařízení.
Nakonec doporučujeme sledovat užitečné video k tématu článku:
Nyní víte, co jsou anody a katody, stejně jako to, jak je rychle zapamatovat. Doufáme, že poskytnuté informace jsou pro Vás užitečné a zajímavé!
Materiály k tématu:
- Jaký je rozdíl mezi střídavým proudem a stejnosměrným proudem?
- Fázové a síťové napětí v síti
- Jak nabíjet baterii doma